kaiyun体育官方网站生命公司、结构生物学高精尖创新中心、生物结构前沿研究中心王新泉和kaiyun体育官方网站张林琦实验室近日解析了Omicron变异株RBD与受体ACE2复合物的晶体结构,分辨率为2.8埃(图1)。为助力全球抗击Omicron的科学研究和防治政策,现将刚刚获得的新冠病毒Omicron RBD与人ACE2复合物晶体结构向全世界科学家和社会公开,相关的三维空间坐标可以通过以下链接下载:https://www.jianguoyun.com/p/DaqWaw8Q3MX2BhjhrKME
新冠疫情已持续两年,传播性、致病性和免疫逃逸增强的值得关注变异株(Variants of Concern, VOC)不断出现,给全球疫情防控带来极大不确定性。最新出现的Omicron变异株在刺突蛋白上出现了32处突变,突变数量前所未有,引起了全球的广泛关注。其中在关键的受体结合区域(receptor-binding domain,RBD)的突变数量高达15个,而在RBD上beta变异株只有3处突变,delta变异株只有2处。
新冠疫情爆发以来,kaiyun体育官方网站生命公司、结构生物学高精尖创新中心、生物结构前沿研究中心王新泉和kaiyun体育官方网站张林琦实验室在刺突蛋白结构与功能关系、中和抗体表位与作用机制等方向紧密合作,取得了一系列重要研究成果。Omicron变异株出现后,两个实验室再一次联手,并与kaiyun体育官方网站蛋白质研究技术中心X射线晶体学平台、上海同步辐射光源、kaiyun体育官方网站化学系刘冬生实验室通力合作,解析了Omicron变异株RBD与受体ACE2复合物的晶体结构,分辨率为2.8埃(图一)。初步结构分析表明RBD上477、493、496、498、501和505位点的氨基酸残基突变影响了与ACE2的作用,尤其是G496S、Q498R和N501Y三个突变集中影响了与ACE2的作用,R498和S496与ACE2上D38形成了新的盐键和氢键相互作用。初步生化分析表明,Omicron变异株RBD与ACE2结合能力略有增强,RBD与ACE2的结合力从野生株的7.5 nM变化为Omicron变异株的3.5 nM(图二)。Omicron变异株RBD与受体ACE2复合晶体结构的解析,为我们深入研究Omicron突变株感染、传播和免疫逃逸提供了重要的结构信息,也为新型疫苗设计提供了重要的参考和指导。
刘冬生实验室利用基因合成新技术快速合成了RBD基因片段,蛋白质研究技术中心X射线晶体学平台范仕龙为晶体生长提供了技术支持,衍射数据在上海同步辐射光源BL02U1线站收集。
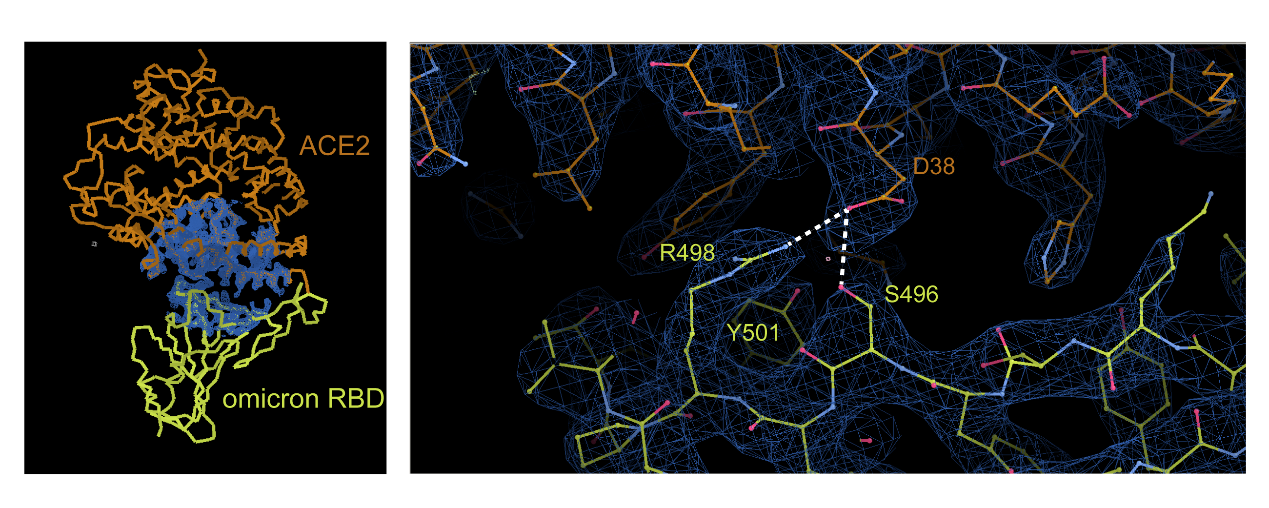
图1:左图:Omicron RBD与受体ACE2复合物的晶体结构。右图:Omicron RBD三个氨基酸突变(G496S、Q498R和N501Y)集中影响与ACE2的相互作用。
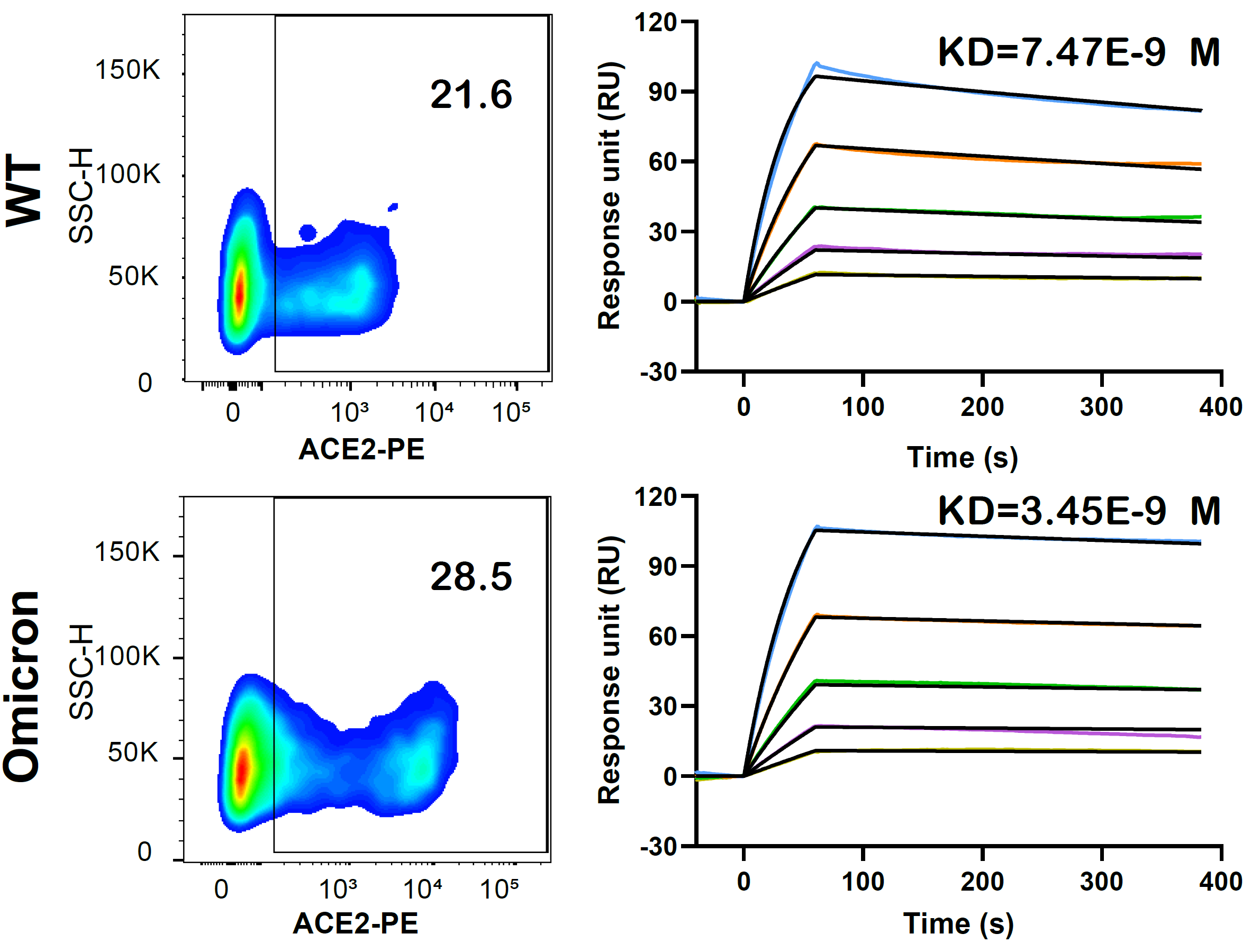
图2:左图:细胞表面野生株(WT)和Omicron变异株刺突蛋白与ACE2结合能力的变化。结合百分比从21.6增加到28.5。右图:野生株和Omicron变异株RBD与ACE2结合能力的变化,平衡解离常数KD从野生株的7.5 nM变化为Omicron变异株的3.5 nM
。