哺乳动物卵母细胞的成熟是一个特殊的生物学过程,该过程中基因的转录被抑制,成熟过程主要受到mRNA翻译的调控。目前卵子成熟的组学研究大都基于基因的转录表达水平,并不能真实的反应卵子成熟过程中基因的翻译表达水平。而翻译组学的研究又需要大量的细胞作为材料或者需要表达纯化标签,不能用于人卵母细胞的研究中。
为了全面揭示人卵子成熟过程中转录-翻译双组学图谱。kaiyun体育官方网站纪家葵课题组、中山大学附属第六医院生殖中心梁晓燕课题组及国内多家生殖中心团队合作,开发出了适用于单个卵母细胞且不需要任何纯化标签的转录-翻译双组学测序技术(T&T-seq),可同时检测单个卵母细胞样本中的总mRNA及正在翻译的mRNA(图1),并进一步研究人卵母细胞成熟的翻译调控机制。该技术也适用于其他细胞类型,包括人胚肾细胞(293FT) 。除了首次揭示人卵转录-翻译双组学图谱,该研究鉴定出OOSP2分泌蛋白对卵子的体外成熟具有促进作用,为临床辅助生殖技术提供新的技术手段。相关研究成果于2022年8月30日以“Single-cell transcriptome and translatome dual-omics reveals potential mechanisms of human oocyte maturation(单细胞转录与翻译双组学揭示人卵母细胞成熟的潜在机制)”为题在线发表在Nature communications (自然-通讯)。

图1.T&T-seq原理示意图
该研究的主要发现如下:
1、利用T&T-seq技术,描绘了小鼠和人类卵母细胞成熟过程中的转录组和翻译组图谱
结果显示,将T&T-seq中获得的翻译组学数据与最近使用100个人类GV或MII卵母细胞的蛋白质组学数据进行比较。T&T-seq翻译组能够鉴定出大约高出10倍的翻译基因数量并且需要更少的细胞使用量(图2a)。作者分别对转录组和翻译组的数据进行了PCA聚类分析。结果发现转录组的 PCA 中卵母细胞和胚胎分离良好,但是GV和MII卵母细胞有部分重叠。相比之下,使用翻译组的相同样本的PCA清楚地分离了 GV 卵母细胞、MII 卵母细胞和胚胎,表明了翻译组要比转录组更能够表现GV和MII卵子之间的差异(图2b)。为了进一步了解转录组和翻译组的全基因组变化,作者使用转录组和翻译组同时分析了GV和MII卵母细胞中的差异基因。根据基因在卵子成熟过程中转录-翻译组的表达水平,作者将这些基因进行了分类。总体而言,大多数表达的基因在在卵子成熟过程中(I+III+IV+V 类)的转录水平保持不变或降低。这点与哺乳动物卵母细胞成熟过程中全基因组转录失活的传统模型是一致的(图2c-d)。此外,在成熟卵子中,基因的翻译效率也要高于未成熟的卵子(图2e,f)。
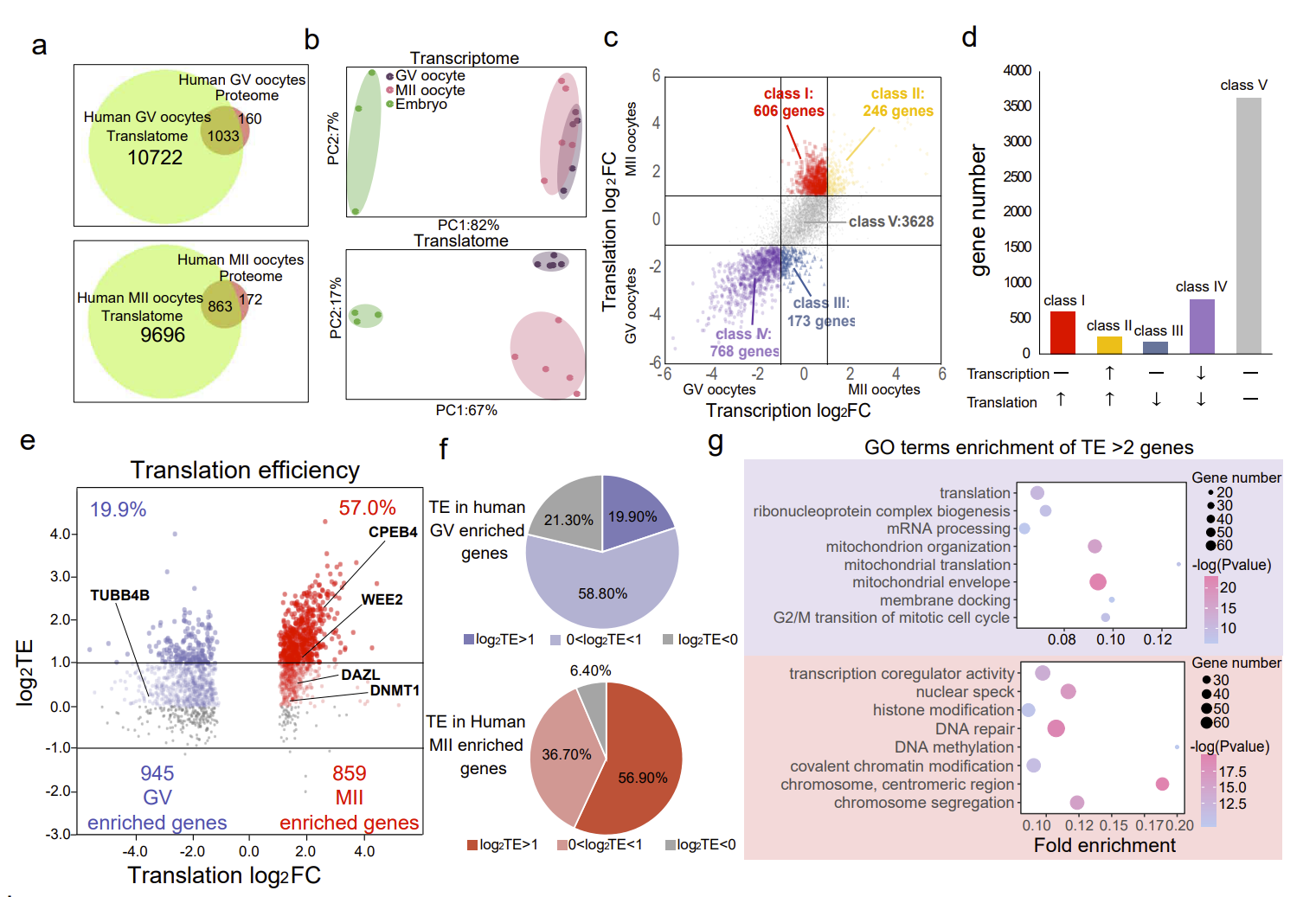
图2. 卵子成熟过程中的转录-翻译双组学变化
2、揭示了人类卵子成熟过程中的时空顺序调节
在未成熟的卵母细胞中,翻译活跃的基因的功能主要是核糖体发生、线粒体合成、细胞质翻译等。而在成熟的卵子中,翻译活跃的基因的功能主要是染色体分离、细胞周期调控、染色体修饰等(图3)。这一结论揭示了卵母细胞成熟过程中基因表达从细胞质到细胞核的顺序调节,在卵子发育的过程中,未成熟的卵子的基因主要在细胞质中发挥功能,成熟的卵子主要在细胞核中发挥功能,表明了卵子成熟的核质不同步性。并且发现成熟卵子中的高翻译效率的基因显著多于未成熟卵子,体现了卵母细胞成熟过程中翻译调控的重要性。
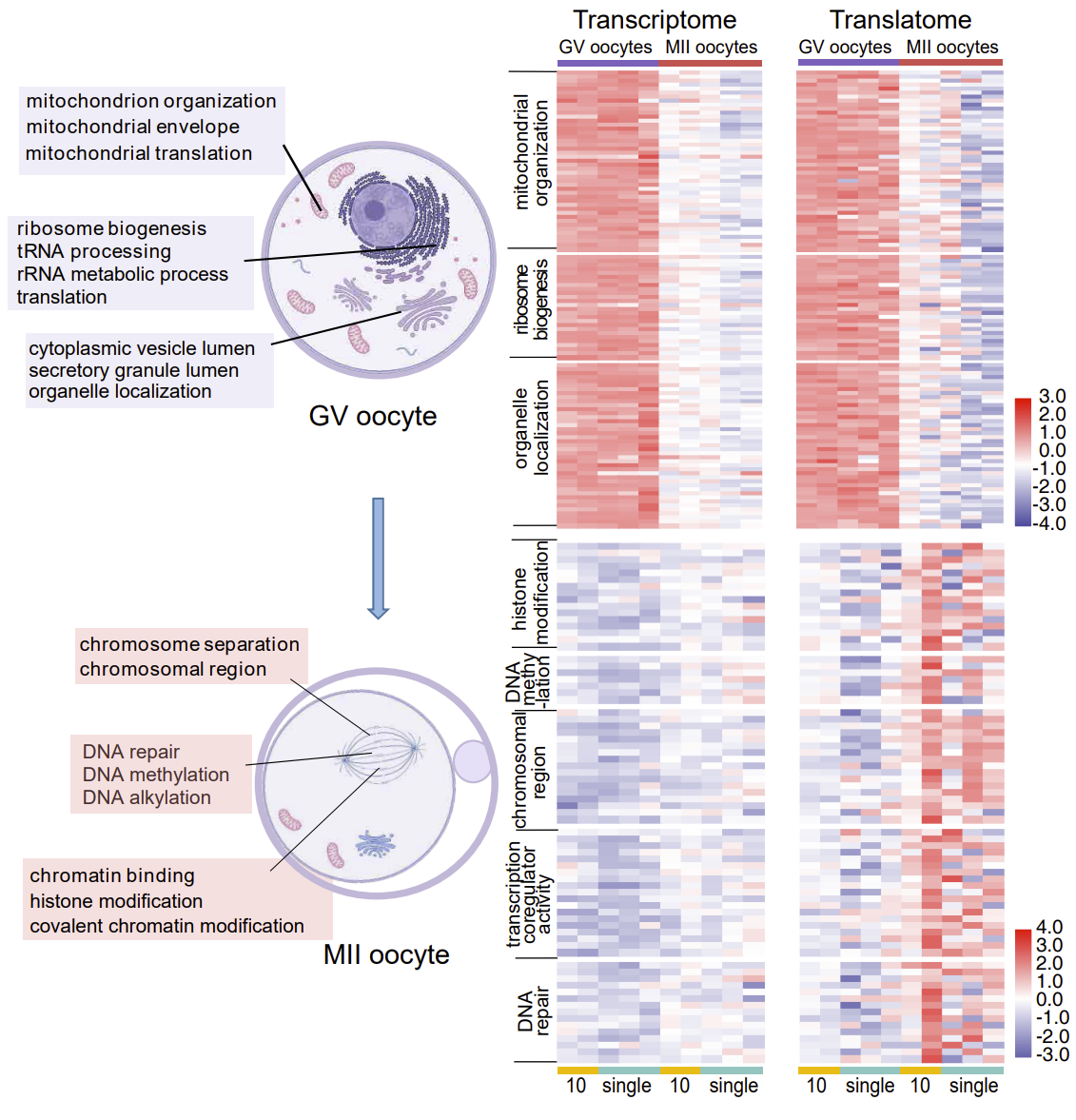
图3. 卵子成熟过程中的时空顺序调节
3、探究高翻译的基因共有的翻译调节元件
先前对小鼠的研究表明,卵母细胞成熟过程中的高翻译表达受基因的3'UTR的RNA结合蛋白(RBP)结合的翻译调节元件的调节(Chen et al., 2011; Sousa Martins et al., 2016; Yang et al., 2020)。然而,由于缺乏翻译组数据集,尚未报道人类卵母细胞中的RBP的基序。因此,作者筛选了人类GV和MII卵母细胞中高翻译效率[ TE(>1)] 基因的3' UTR,来用于识别潜在的RBP识别基序,并寻找RBP作为潜在的翻译调节因子。根据这些条件,作者筛选出了高TE MII基因中的RBP结合基序,他们分别是FXR1、PCBP1、DDX3X、CPEB2和CPEB4 的结合基序(图4a)。此外,作者还鉴定出卵母细胞成熟相关的GO聚类中的高 TE基因,例如“染色体分离”、“减数分裂细胞周期”和“甲基化”(图4b)。
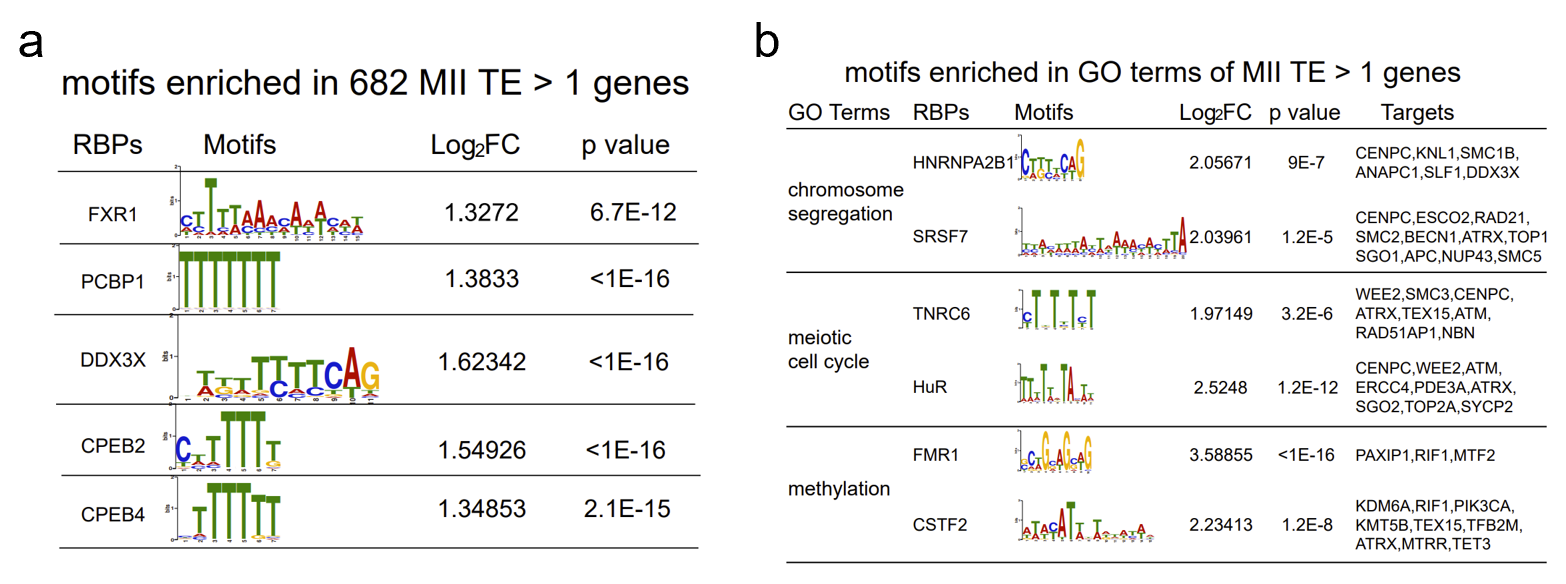
图4. 高翻译基因3‘UTR富集出的RBP结合基序
4、比较小鼠与人类卵母细胞的翻译组成熟过程中的表达模式
小鼠模型常用于研究和推断人类卵母细胞成熟的机制,然而,有一些独特的翻译表达模式可能只存在于人类卵母细胞中,仅用小鼠数据得出的结论可能不适用于人卵成熟。因此,基于小鼠和人类卵母细胞的T&T-seq,作者比较和对比了这两个物种的翻译组,鉴定出了一些不同翻译模式的基因,例如OOSP蛋白家族的基因。在小鼠OOSP家族中,OOSP1和OOSP3蛋白都是在成熟过程中表达上调的,而OOSP2蛋白是在成熟过程中表达下调。然而在人的OOSP家族中却正好相反。作者发现小鼠OOSP2基因只有一个PAS基序,而OOSP1和OOSP3均有多个与PAS基序相邻的CPE基序。相比之下,人类OOSP2是唯一同时携带CPE和PAS的OOSP基因(图5)。

图5. CPE位点和PAS基序可能调控分泌蛋白的翻译
5、发现添加OOSP2蛋白可以提高人卵体外成熟率,並揭示 OOSP2诱导卵母细胞成熟的分子机制
为了探究OOSP2是否对卵子的成熟具有调控作用,作者从捐赠者收集了GV卵母细胞,并使用带有延时显微镜的孵化器来监测卵母细胞的成熟。核膜破裂(GVBD)和极体排出(PBE)是在显微镜下卵母细胞成熟后形态变化的两个阶段(图6)。当观察到 PBE 时,卵母细胞则被认为是成熟的。在每组实验中作者比较来自相同供体的成对 GV 卵母细胞,以消除不同供体的异质性,并且分别记录了实验组和对照组卵子的GVBD的时间以及PBE的时间。作者发现添加OOSP2蛋白可以提高人卵体外成熟率。而添加OOSP2的抗体则会阻断了OOSP2蛋白的功能,从而影响了卵子的成熟过程。
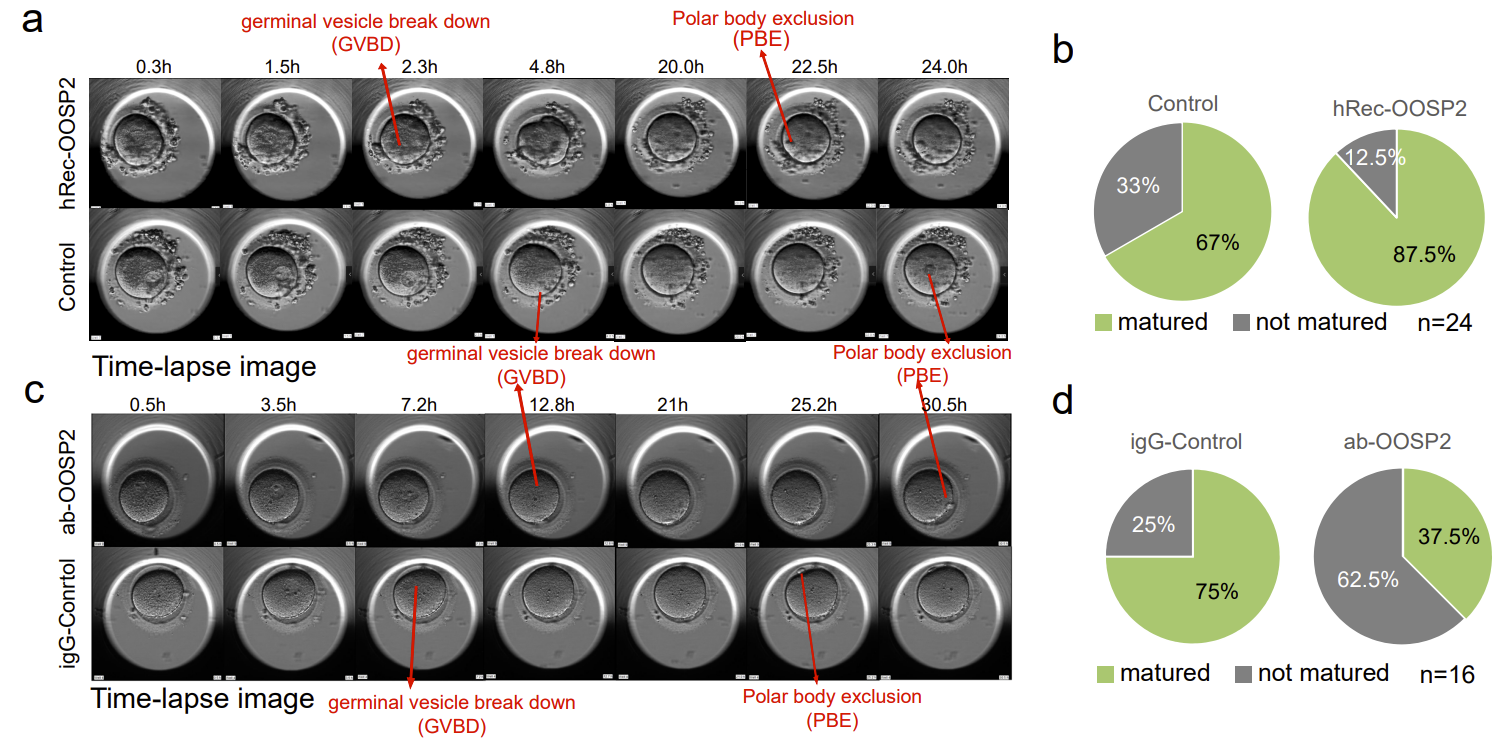
图6. OOSP2蛋白可促进人卵体外成熟
通过使用single-cell T&T-seq揭示了hRecOOSP2 处理过的GV期卵母细胞的转录组和翻译组,鉴定OOSP2的潜在诱导基因或途径。OOSP2可以直接调控下游基因的翻译,并通过上调特定的信号通路,如小GTPase信号通路、细胞器定位通路等,来促进卵母细胞的核质成熟。拟时序分析也证明相比于未成熟卵子,OOSP2蛋白处理过的卵母细胞更接近于成熟卵子(图7)。
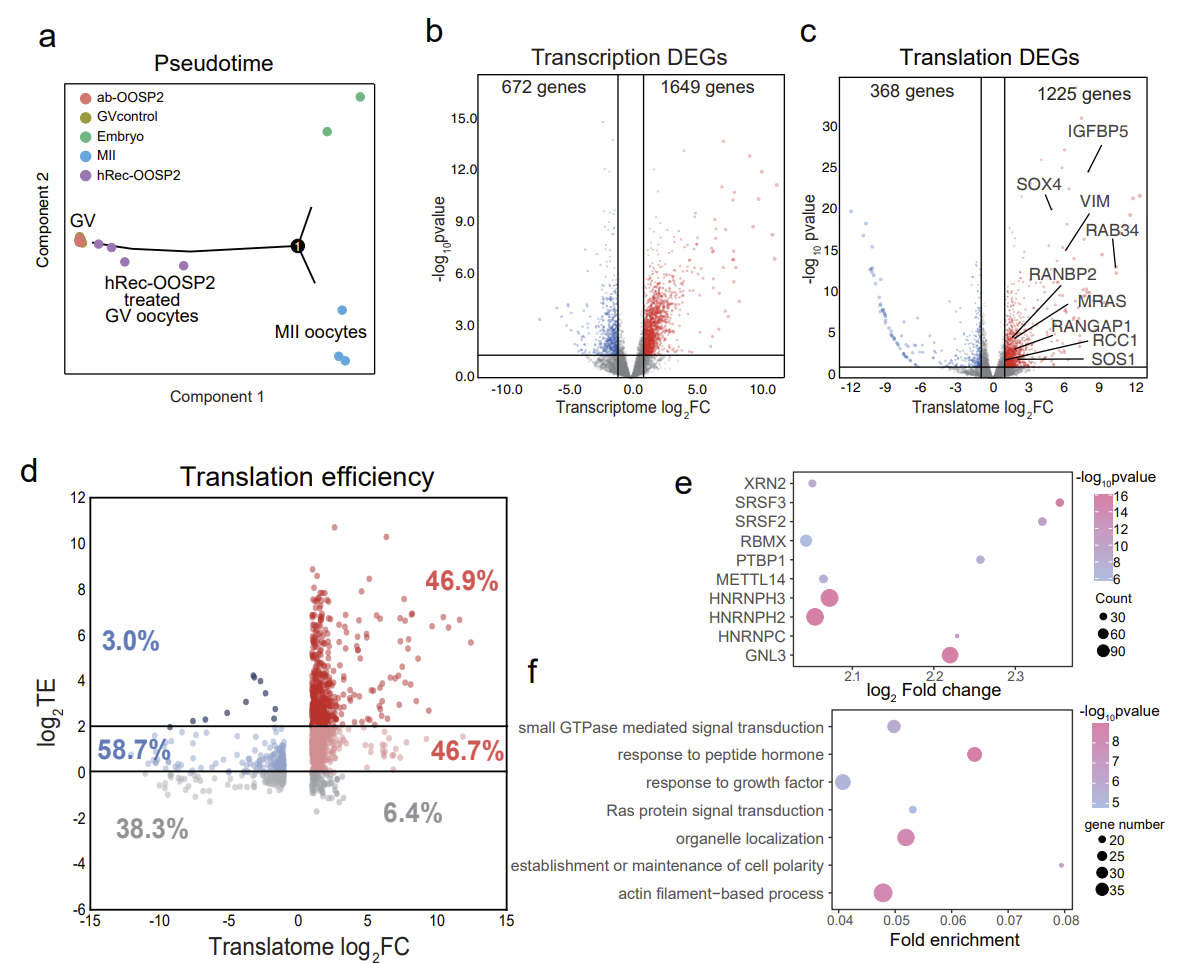
图7. OOSP2诱导卵母细胞成熟的分子机制
综上所述,本研究开发出了适用于单个卵母细胞的T&T-seq,首次揭示人卵翻译双组学图谱, 揭示了人类卵子成熟过程中的时空顺序调节; 揭示了小鼠和人类两个物种的卵子成熟过程中的翻译组学图谱的异同; 阐释了CPE基序对卵子成熟过程中分泌蛋白翻译的调控作用; 鉴定出OOSP2分泌蛋白对卵子的成熟具有重要的作用; 揭示了OOSP2可能通过调控小GTPase信号通路相关蛋白的翻译来促进卵母细胞的成熟,为临床卵母细胞体外成熟技术提供新的技术方法及理论依据。
kaiyun体育官方网站2017级博士生胡文奇和中山大学附属第六医院生殖中心曾海涛主任医师为该论文的并列第一作者,kaiyun体育官方网站纪家葵教授和中山大学附属第六医院生殖中心梁晓燕教授为该论文的共同通讯作者。同济大学上海第十人民医院千日成教授课题组,南京医科大学第一附属医院崔毓桂教授课题组,山东大学齐鲁kaiyun体育官方网站吴克良教授课题组,温州医科大学第一附属医院倪吴花副教授课题组共同参与该项目前期的研究工作。该项目得到了科技部重点研发项目(2017YFC1001600)的支持。
原文链接:https://www.nature.com/articles/s41467-022-32791-2